增強具有光催化性能的共價有機框架(COF)與水凝膠的協同作用,仍然是擴大其生物應用所面臨的一項緊迫挑戰。在此,將COF均勻涂覆在氧化碳納米管(OCNT)上并與Fe
3+配位以獲得管狀納米復合物OCNT@COF-Fe(O@CF)。結果表明,包裹的OCNT和配位的Fe
3+增強了O@CF的光動力活性氧(ROS)產生能力,它們分別可以作為分子間電荷轉移通道和電子受體/基質(O
2和H
2O)吸附劑縮小能帶隙,增加光吸收,減少光生載流子復合。協同作用下,O@CF 表現出 pH 依賴性過氧化物酶和過氧化氫酶活性,分別進一步增強 ROS 生成并緩解缺氧。同時,O@CF 會導致 COF 涂層相關的光熱性能下降。然后,通過COF涂層參與的共價交聯,將O@CF均勻地摻入希夫堿水凝膠中,得到導電水凝膠OCNT@COF-Fe@Gel(O@CF@G)。這種O@CF@G不僅可以提高純凝膠的力學性能,而且繼承了O@CF的多功能。因此,它可以很好地粘附在糖尿病傷口上,進行吸收、消除耐藥生物膜、殺滅革蘭氏陽性和陰性細菌、緩解缺氧和細胞間電信號傳導,從而加速傷口愈合。
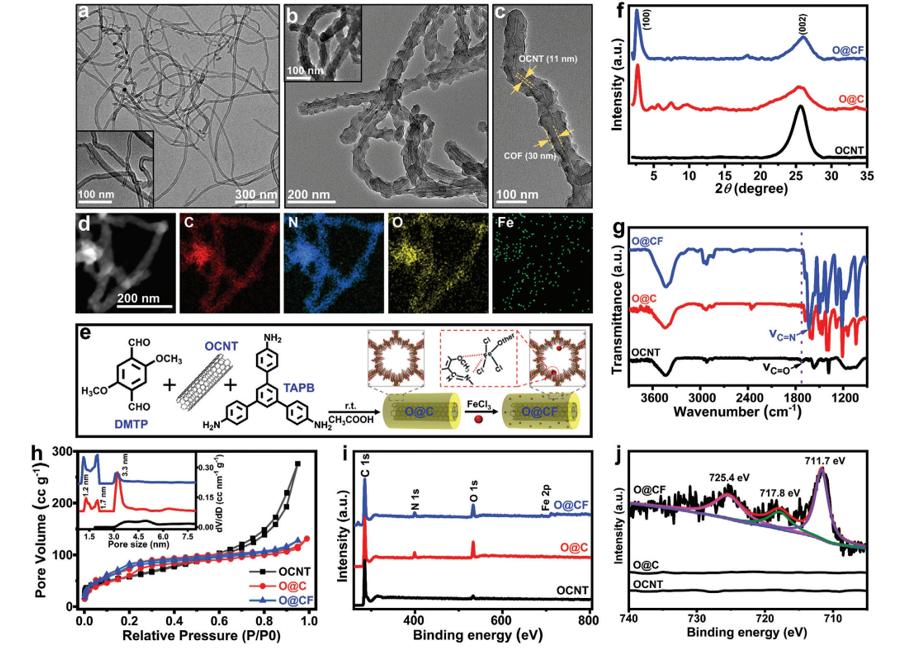
Fig 1. a) OCNT 的 TEM 圖像。 b,c) O@CF 的不同放大 TEM 圖像。 (b) 中的插圖是 O@C 的 TEM 圖像。 d) O@CF 的 STEM 圖像和相應的 EDS 元素映射。 e) O@CF的制備示意圖。 f) XRD 圖譜,g) FTIR 光譜,h) 氮吸附-脫附等溫線和孔徑分布曲線(插圖),i) XPS 測量光譜,j) OCNT、O@C和O@CF 的高分辨率 Fe 2p XPS 光譜。

Fig 2. a)相同OCNT濃度的OCNT、O@C和O@CF溶液在808 nm照射(1.5 W cm
−2)下不同時間段的光熱圖??像。 b) TMB 溶液的紫外可見光譜和相應的照片(插圖),用于通過與 H
2O
2 溶液孵育 20 分鐘來探測不同材料的 ROS 生成。 c) TMB 溶液在 652 nm 處的吸光度和 EPR 光譜(插入),用于通過在不同 pH 緩沖液下與 H
2O
2 溶液一起孵育 20 分鐘來探測 O@CF 的·OH 生成。 ·OH自由基被DMPO捕獲。 d) 通過在pH 7.4下與H
2O
2溶液一起孵育不同材料的溶解O
2含量曲線。 e) 在不同 pH 緩沖液下與 H
2O
2 溶液孵育 10 分鐘后,O@CF 溶解 O
2 含量的變化。 f) TMB 溶液在 652 nm 處的吸光度,用于探測 COF、O@C 或 O@CF 在不同波長單色光照射下 15 分鐘的 ROS 生成。 g) TMB 溶液在 652 nm 處的吸光度和照片(插圖),用于在不同 pH 值下通過 500 nm 單色光照射 15 分鐘來探測不同材料的 ROS 生成。 h) KI-(NH
4)MoO
4 溶液在 352 nm 處的吸光度,用于在不同 pH 值下通過 500 nm 單色光照射 15 分鐘來探測不同材料的 H
2O
2 生成。 i) KI-(NH
4)MoO
4 溶液的紫外可見光譜,用于通過 500 nm 單色光在 pH 6.0 下照射 15 分鐘來探測不同材料的 H
2O
2 生成。數據表示為平均值±SD (n = 3)。

Fig 3. TMB 溶液的紫外可見光譜,用于通過 500 nm 單色光照射 15 分鐘、pH 6.0 探測 O@CF 的 ROS 生成:a) 在不同反應介質存在下,b) 在不同反應氣氛下,c) 在不同自由基清除劑的存在。 h
+scavenger: EDTA-2Na, e
−scavenger: DMSO,
1O
2 scavenger: L-histidine, ·O
2 scavenger: CHCl
3, ·OH scavenger: isopropanol.。 d) O@CF溶液在pH 6.0下經500 nm單色光照射15分鐘得到的EPR光譜。條件:·OH和·O
2自旋捕獲劑:DMPO;
1O
2 自旋捕獲器:TEMP。e) UV-vis-NIR DRS 光譜和相應的 Kubelka-Munk 函數圖以及不同粉末的計算帶隙(插入)。 f) COF、O@C 和 O@CF 粉末的 PL 光譜(Ex = 350 nm)。分別是COF、O@C和O@CF的g)電化學阻抗和h)光電流響應光譜。 i) O@CF 在不同 pH 緩沖液中處理 30 分鐘后的接觸角。
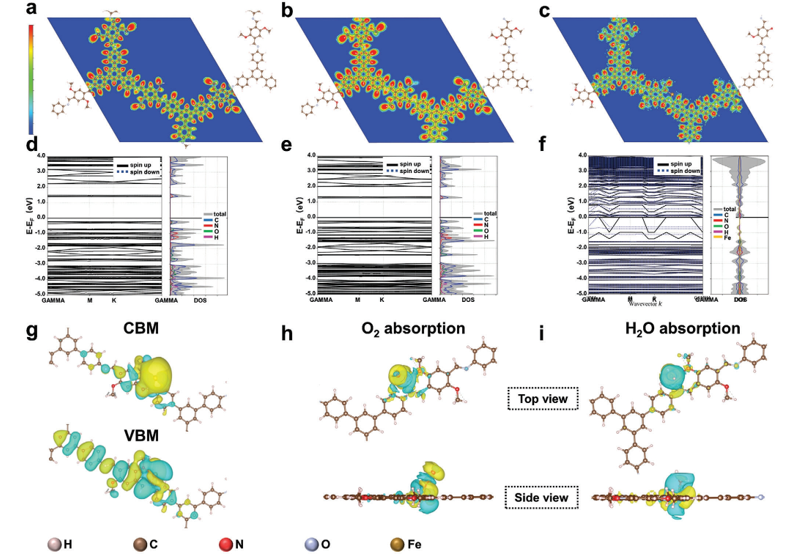
Fig 4. 理論計算。 a–c) 電子局域密度圖和 d–f) 能帶結構,分別具有 COF、O@C 和 O@CF 的狀態密度圖。 g)O@CF的導帶邊緣(CBM)和價帶邊緣(VBM)的微分電荷密度圖。 h,i) O@CF 上的 O
2 吸附和 O@CF 上的 H
2O 吸附的差分電荷密度圖。黃色區域是電荷豐富的區域,藍色區域是電荷缺乏的區域
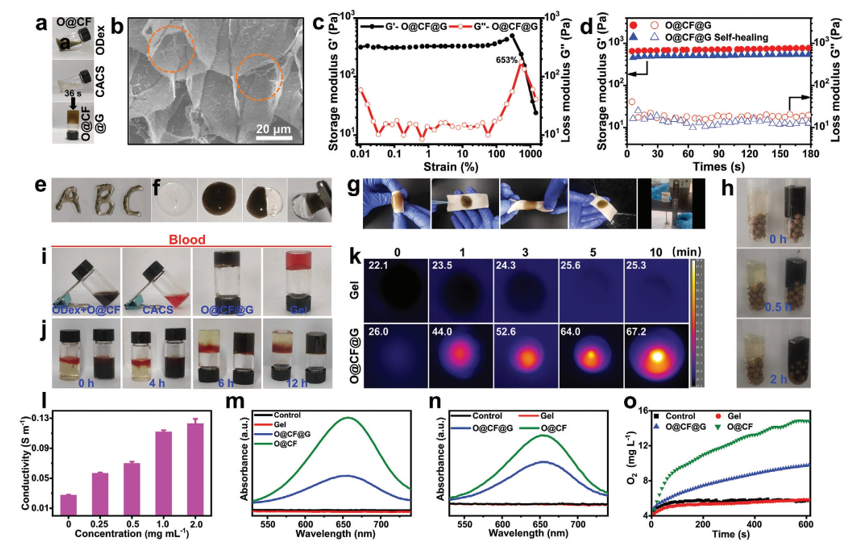
Fig 5. a)O@CF@G水凝膠形成過程的光學圖像。 b)O@CF@G水凝膠網絡的SEM圖像。橙色圓圈表示 O@CF 納米管。 c)O@CF@G水凝膠的應變掃描曲線。 d)未切割的O@CF@G水凝膠和自修復后切割的水凝膠的振蕩時間掃描曲線。 e) 通過 22 G 針注射的 O@CF@G 水凝膠的照片。 f) Gel 和 O@CF@G 的兩個半圓形水凝膠接觸 15 分鐘的自愈過程照片。 g) O@CF@G分別在彎曲、翹曲、水洗、吹氣和拉伸下對豬皮的粘附力照片。 h) Gel和O@CF@G通過重力驅動向下滲透的自適應照片。 i,j) 在血細胞存在下水凝膠形成過程的照片(上排)以及 Gel 和 O@CF@G 之間血液吸收能力的比較。 k)Gel和O@CF@G在808 nm照射下不同時間段(1.5 W cm
−2)的光熱圖像。 l)不同O@CF濃度的O@CF@G水凝膠的電導率。 m,n) TMB 溶液的紫外可見光譜,用于通過 m) 與 H
2O
2 孵育或 n) 用 500 nm 單色光 (100 mW cm
−2) 照射 15 分鐘來探測 (pH 6.0) 不同配方的 ROS 生成。 o) 通過與 H
2O
2 溶液 (pH 6.0) 孵育不同時間段來測量不同配方的溶解 O
2 含量。數據表示為平均值±SD (n = 3)。
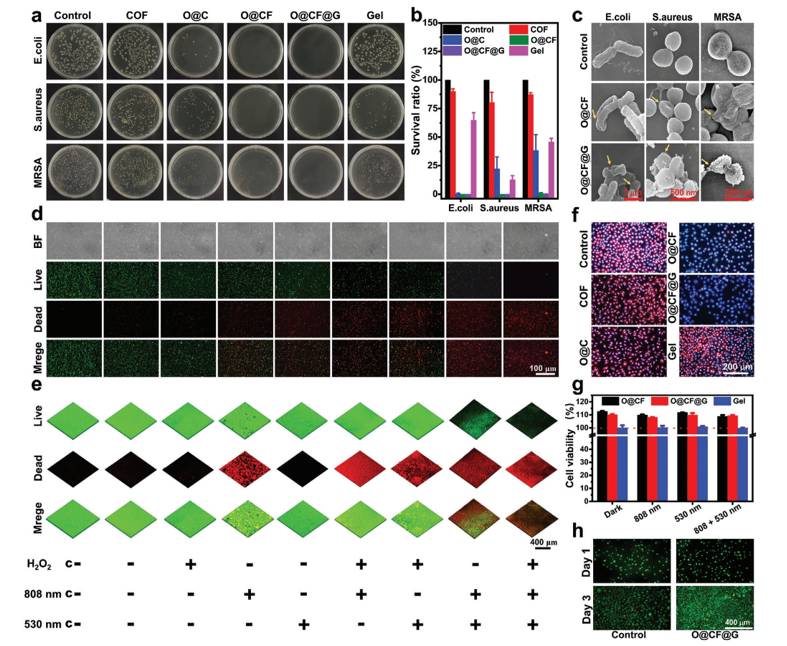
Fig 6. a) 瓊脂板圖像和 b) 與不同制劑在 37 ℃下孵育 2 小時后大腸桿菌、金黃色葡萄球菌和 MRSA 的相應抗菌比率。 c) 與不同制劑一起孵育 2 小時的大腸桿菌、金黃色葡萄球菌和 MRSA 的 SEM 圖像。箭頭顯示破裂的膜和流出的細胞質。 d,e) 不同處理下與O@CF@G一起孵育的MRSA細菌和MRSA生物膜(放大倍數=15×)的活死染色CLSM圖像(放大倍數=40×),其中“c-”代表對照組沒有任何材料(BF:明場,綠色:活,紅色:死)。 f) 用不同制劑孵育的 L929 細胞的細胞內 O
2 生成測試的 CLSM 圖像(藍色:DAPI,紅色:O
2 探針 [Ru(dpp)
3Cl
2])。 g) 不同處理后第3天L929細胞的活力直方圖。 h) 不同處理后第1天和第3天L929細胞的活-死染色圖像(綠色:活,紅色:死)。數據表示為平均值±SD (n = 3)。

Fig 7. 通過不同配方對體內 MRSA 感染的糖尿病傷口進行治療。 a) 傷口照片和 b) 相關傷口區域。 c)革蘭氏染色圖,d,e)治療后第6天創面組織Ki67免疫組化染色圖及相應的Ki67 IHC分析統計圖。 (c) 中標記為金黃色葡萄球菌的黑色窗格和圓圈染成紫色。黑色箭頭表示染成深棕色的細胞的高陽性表達。 f) 分別是治療后第 6 天和第 12 天傷口組織的 H&E 染色圖像和 g) Masson 染色圖像。 (f)中的黑色箭頭表示炎性中性粒細胞,而(g)中的紅色箭頭、綠色窗格和黑線分別標記膠原沉積、毛囊和皮膚表皮厚度。 h–k) 分別在治療后第 6 天和第 12 天傷口組織中 h) CD31、i) TNF-










